在细胞群体中总有一些因各种原因而死亡的细胞,总细胞中活细胞所占的百分比叫做细胞活力(cell viability)。细胞活力测定方法有MTT法、克隆(集落)形成法、台盼蓝染色法、3H放射性同位素掺入法等。其中MTT法以其快速简便,不需要特殊检测仪器、无放射性同位素、适合大批量检测的特点而得到广泛的应用。但MTT法形成的Formazan为水不溶性的,需要加有机溶剂溶解,由于在去上清操作时会有可能带走小部分的Formazan,故有时重复性略差。为了解决这个问题,研究人员又开发了很多种水溶性的四氮唑盐类:如CCK-8(WST-8)、XTT等。结合实际每种方法的优缺点,汉恒生物目前提供以下几种服务。每种实验服务均有所不同,详细请联系汉恒生物的技术服务人员:400-092-0065
MTT
MTT分析法以活细胞代谢物还原剂3-(4,5)-dimethylthiahiazo (-z-y1)-3,5-di- phenytetrazoliumromide, MTT噻唑蓝为基础。MTT为黄色化合物,是一种接受氢离子的染料,可作用于活细胞线粒体中的呼吸链,在琥珀酸脱氢酶和细胞色素C的作用下tetrazolium环开裂,生成蓝色的formazan结晶,formazan结晶的生成量仅与活细胞数目成正比(死细胞中琥珀酸脱氢酶消失,不能将MTT还原)。还原生成的formazan结晶可在含50%的N,N-二甲基甲酰胺和20%的十二甲基磺酸钠(pH 4.7)的MTT溶解液中溶解,利用酶标仪测定490 nm处的光密度OD值,以反映出活细胞数目。也可以用DMSO来溶解。
MTT粉末和配置好的溶液都需要用铝箔纸包好避光保存。实验的时候尽量关闭超净台上的日光灯进行避光操作。
步骤如下:
1:接种细胞:用含10%胎小牛血清的培养液配成单个细胞悬液,以每孔 1000-10000个细胞的密度接种到96孔板中,每孔体积200ul.
2:培养细胞:同一般培养条件,培养3-5天(可根据试验目的和要求决定培养时间)。
3:呈色:培养3-5天后,每孔加MTT溶液(5mg/ml用PBS 配)20ul. 继续孵育4小时,终止培养,小心吸弃孔内培养上清液,对于悬浮细胞需要离心后再吸弃孔内培养上清液。每孔加150ul DMSO,振荡10分钟,使结晶物充分融解。
4:比色:选择490nm波长,在酶联免疫检测仪上测定各孔的光吸收值,记录结果,以时间为横坐标,吸光值为纵坐标来绘制细胞生长曲线。
注意事项:
(1)选择适当的细胞接种浓度。
(2)避免血清干扰:一般选小于10%的胎牛血清的培养液进行试验。在呈色后尽量吸尽孔内残余培养液。
(3)设空白对照:与试验平行,不加细胞只加培养液的孔设为空白对照。其他试验步骤保持一致,最后比色以空白调零。
CCK8
Cell Counting Kit简称CCK8试剂盒,是一种基于WST-8(化学名:2-(2-甲氧基-4-硝苯基)-3-(4-硝苯基)-5-(2,4-二磺基苯)-2H-四唑单钠盐)的广泛应用于细胞增殖和细胞毒性的快速高灵敏度检测试剂盒。
WST-8属于MTT的升级产品,工作原理为:在电子耦合试剂存在的情况下,可以被线粒体内的脱氢酶还原生成高度水溶性的橙黄色的甲臜产物(formazan)。颜色的深浅与细胞的增殖成正比,与细胞毒性成反比。使用酶标仪在490mM波长处测定OD值,间接反映活细胞数量。
实验步骤(以下为药物处理实例)
1、在96孔板中配置100μL的密度为2×104个/ml的细胞悬液。将培养板在培养箱预培养24小时(37℃,5% CO2)。
2、按一下浓度梯度和时间点,加药物处理;
3、将培养板在培养箱孵育一段时间(0-7天共8个时间点)。
4、向每孔加入10μL CCK8溶液(注意不要再孔中生成气泡,它们会影响OD值的读数。
5、将培养板在培养箱内孵育1小时。
6、用酶标仪测定在450nm处的吸光度。

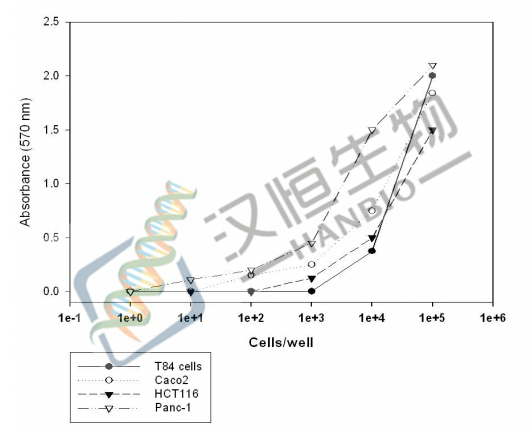
通常研究药物毒性时会涉及半抑制率,即IC50,,意思是抑制率50%的时候药物的浓度。把药品稀释成不同的浓度,然后计算各自的抑制率,以药品的浓度为横坐标,抑制率为纵坐标作图,然后得到50%抑制率时候的药品浓度,就是IC50。
BrdU掺入实验
溴脱氧尿嘧啶核苷是DNA前体胸腺嘧啶核苷类似物,通过竞争掺入S期细胞单链DNA核苷酸序列替代胸腺嘧啶。BrdU与胸腺嘧啶竞争掺入的强溴脱氧尿嘧啶核苷是DNA前体胸腺嘧啶核苷类似物,通过竞争掺入S期细胞单链DNA核苷酸序列替代胸腺嘧啶。BrdU与胸腺嘧啶竞争掺入的强度可能与细胞增殖异常有关,如肝癌细胞约11.6%的胸腺嘧啶被替代,而正常肝细胞仅有1.1%。
既往在分子遗传学等研究中常采用同位素标记,但有放射污染,技术难度大,实验周期长等缺点。近年来非放射性标记物的研究发展迅速,然而其敏感性多数不及同位素,使实验应用受限。自82年Gratzer制备出抗BrdU单抗及标记检测技术不断改良提高,应用BrdU标记的敏感性已与氘胸腺嘧啶核苷相似。目前认为BrdU是最有希望取代同位素的非放射性标记物之一。
详细步骤:
第1天
1. 用100μM的BrdU工作液(用5mg/ml的储存液以6μL/mL稀释而成)标记细胞。 胚胎干细胞,30分钟 ;3T3细胞,2.5小时 ;二倍体成纤维细胞,4-6小时。
2. 胰酶消化细胞,用PBS洗脱,400×g或1700rpm离心5分钟,去上清,加入10 mL 70% EtOH重悬。
3. 保存在-20℃过夜或数天。
第2天
1. 将第一天的标本离心去上清,并用洗涤缓冲液(PBS + 0.5% IFS)洗涤。
2. 离心去上清,以0.5 mL 2M HCl + 0.5% IFS (Keratin intermediate filaments (IFs)必须新鲜配制!),室温孵育20分钟。
3. 加入1ml洗涤缓冲液洗涤细胞。
4. 离心去上清,以0.1M的四硼酸钠(Na2B4O7)重悬细胞,室温孵育2分钟。
5. 用1ml洗涤缓冲液洗涤细胞2次(分出一部分细胞用于PI单染,见第10步)
6. 用50μL洗涤缓冲液重悬细胞,加入anti-BrdU抗体,4℃孵育20分钟。
7. 加入1.5ml洗涤缓冲液洗一次。
8. 用50μL洗涤缓冲液重悬细胞,加入用于封闭Fc段的抗体(如FITC-conjugated rabbit anti-mouse (F(ab')2 fragments等),4℃孵育20分钟。
9. 加入1.5ml洗涤缓冲液洗涤一次。
10. 以0.3ml PI(10μg/ml)重悬细胞,室温孵育30分钟。准备上机。
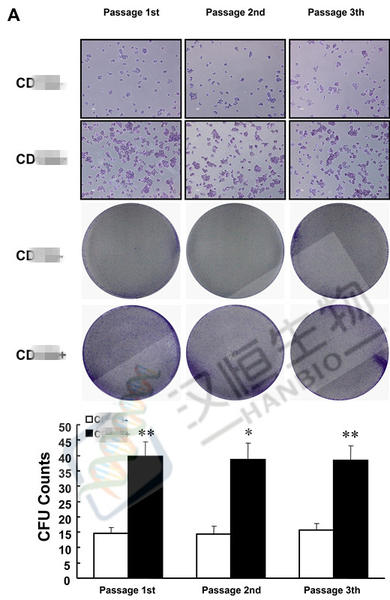
克隆形成实验colony forming assay
细胞接种存活率只表示接种细胞后贴壁的细胞数,但贴壁后的细胞不一定每个都能增殖和形成克隆。而形成克隆的细胞必为贴壁和有增殖活力的细胞。克隆形成率反映细胞群体依赖性和增殖能力两个重要性状。由于细胞生物学性状不同,细胞克隆形成率差别也很大,一般初代培养细胞克隆形成率弱,传代细胞系强;二倍体细胞克隆形成率弱,转化细胞系强;正常细胞克隆形成率弱,肿瘤细胞强。并且克隆形成率与接种密度有一定关系,做克隆形成率测定时,接种细胞一定要分散成单细胞悬液,直接接种在碟皿中,持续一周,随时检查,到细胞形成克隆时终止培养。
(1)、培养分选的两组细胞,取对数生长期的各组细胞,分别用0.25%胰蛋白酶消化并吹打成单个细胞,并把细胞悬浮在10%胎牛血清的DMEM培养液中备用。进行一代克隆形成率检测时,进入步骤(2);进行二/三代克隆形成率检测,须再经此方法再培养一/二代,再取对数期细胞,进入步骤(2)。
(2)、将细胞悬液作梯度倍数稀释,每组细胞分别以每皿50、100、200个细胞的梯度密度分别接种含10mL 37℃预温培养液的皿中,并轻轻转动,使细胞分散均匀。置37℃ 5% CO2及饱和湿度的细胞培养箱中培养2~3周。
(3)、经常观察,当培养皿中出现肉眼可见的克隆时,终止培养。弃去上清液,用PBS小心浸洗2次。加4%多聚甲醛固定细胞5mL固定15分钟。然后去固定液,加适量Giemsa应用染色液染10~30分钟,然后用流水缓慢洗去染色液,空气干燥。
(4)、将平皿倒置并叠加一张带网格的透明胶片,用肉眼直接计数克隆,或在显微镜(低倍镜)计数大于10个细胞的克隆数。最后计算克隆形成率。
克隆形成率 =(克隆数/接种细胞数)×100%
参考文献
1、miR-223 is upregulated in monocytes from patients with tuberculosis and regulates function of monocyte-derived macrophages; (2014年发表于Molecular immunology,作者:Xiaoxing Cheng) 2、Effect of TRPV1 combined with lidocaine on cell state and apoptosis of U87-MG glioma cell lines; (2015年发表于Asian Pacific Journal of Tropical Medicine,作者:卢军)
- 浏览 33311 次