- 产品主页
- 产品
- 服务
- 专题
- 实验视频
- 回到官网


 人才招聘
人才招聘 代谢是生物体内所发生的用于维持生命的一系列有序的化学反应的总称。常见的代谢性疾病有糖尿病、肥胖症、骨质疏松、痛风、脂质代谢紊乱以及甲状腺、垂体、肾上腺、性腺、甲状旁腺等疾病。
一、疾病模型
(一)糖尿病模型。糖尿病是一组以高血糖为特征的代谢性疾病。高血糖则是由于胰岛素分泌缺陷或其生物作用受损,或两者兼有引起。在对糖尿病的研究中,常见的模型包括:
1. 一型糖尿病模型
A 药剂诱导型:①STZ(streptozocin),链脲菌;②Alloxan, 四氧嘧啶
B 自发型:①NOD(non-obese diabetes)小鼠;② AKITA 小鼠
2. 二型糖尿病模型
A 肥胖二型糖尿病模型
① db/db 小鼠
② ob/ob 小鼠
③ Zucker fatty 大鼠
④ ZDF(Zucker diabetic fatty)大鼠
⑤ 果糖(fructose)长期饮食的二型糖尿病动物模型⑥果糖短期饮食+低剂量 STZ 一次投药
B 瘦型二型糖尿病模型
GK(Goto-Kakizaki )大鼠
(二)肥胖症模型。肥胖症是一组常见的,古老的代谢症群。当人体进食热量多于消耗热量时,多余热量以脂肪形式储存于体内,其量超过正常生理需要量,且达一定值时遂演变为肥胖症。在对肥胖的研究中,常见的模型有:
1. 谷氨酸钠(MSG)诱导的肥胖动物模型
新生小鼠或大鼠皮下注射 MSG 可诱导其产生肥胖。脂肪堆积是 MSG 肥胖动物的主要表现,其体脂在 2 周龄时即显着增加,一直增加到 4 月龄时。在 30~90d 时即已形成脂肪肝。
2 . 金硫葡萄糖(GTG)致肥胖模型
给成年小鼠腹腔注射 GTG 可诱导其产生肥胖, GTG 所诱导的肥胖,被人们普遍认为系下丘脑「饱中枢」受损所致,因用 GTG 后,可观察到小鼠的 VMH 的苍白球部的细胞、神经纤维网和血管遭受破坏。用电烧灼以破坏该部位同样可引起多食和肥胖。
3 . 食物诱导的肥胖动物模型
高脂食物、高糖食物均可引起肥胖,另外可口的食物如糖果、可可、乳酪、意大利腊肠及加糖的浓牛奶等均可诱导肥胖;除此之外,过度摄入食物亦可导致肥胖。
(三)高血脂模型
1、LDLR-/-小鼠模型:低密度脂蛋白受体缺陷型小鼠模型小鼠有以下特点:
(1)胰岛素抵抗容易被诱导,有利于药物或保健食品对胰岛素抵抗作用的筛选和效果观察;(2)在高脂模型饲料喂养后很快发生血浆胰岛素水平升高、血糖升高(糖尿病),因此,LDLR-/-小鼠是胰岛素抵抗向 II 型糖尿病发展的理想模型;(3) LDLR-/-小鼠的血脂和胆固醇分别非常接近人类(见「不同动物之间以及与人类血脂和脂蛋白代谢与转运的比较」),在该小鼠中研究胰岛素抵抗与血脂改变的关系,比在大鼠和普通小鼠中研究有独特的优势。
(4) 高脂模型饲料喂养后 LDLR-/-小鼠容易发生肥胖、非酒精性脂肪肝和动脉粥样硬化,在该小鼠中研究胰岛素抵抗有利于分析胰岛素抵抗与这些疾病的关系。
该模型小鼠在喂养高脂模型饲料后的几周内发生胰岛素抵抗、高胰岛素血症,并且很快发生高血糖。根据研究报道,胰岛素抵抗发生后持久维持。但相继发生脂肪肝和动脉粥样硬化,因此,应当根据你的研究具体情况确定最合适的造模时间。
2、ApoE-/-小鼠/大鼠模型:高脂高胆固醇模型饲料进行的 ApoE 敲除小鼠动脉粥样硬化造模中,脂肪和胆固醇都在对动脉粥样硬化形成和发展中起作用。其中,脂肪引起代谢综合症表现(胰岛素抵抗、肥胖,等等),从而推动动脉粥样硬化的形成,而胆固醇本身也在起作用,胆固醇的作用取决于模型饲料中胆固醇的含量。
3、两者区别:APOE-/-为自发的动脉粥样硬化模型,与人的动脉粥样硬化进程更为相似。而 LDLR-/-在正常饮食情况,不会出现动脉粥样硬化斑块,需要高胆固醇饲料诱导。
(四)除此之外,由于肝脏是身体内以代谢功能为主的器官,并在身体里面有着去毒素,储存糖原(肝糖)等功能。基于肝脏常见的模型还包括:
1. 肝损伤动物模型
① 化学性肝损伤模型。
② 免疫性肝损伤模型。
③ 酒精性肝损伤模型。
2. 病毒性肝炎模型
① 甲型肝炎病毒(HAV)动物模型采用的实验动物有黑猩猩、绒毛猴豚鼠、豚鼠。
② 乙型肝炎病毒(HBV)动物模型采用的实验动物有美洲旱獭、黄鼠属啮齿动物等。
③ 丙型肝炎病毒(HCV)所采用的动物有黑猩猩、树鼠句、转基因小鼠。
④ 丁型肝炎病毒(HDV)所采用的动物有黑猩猩、美洲旱獭、树鼠句。
⑤ 戊型肝炎病毒(HEV)所采用的动物有非人灵长类动物和猪。
3. 肝纤维化动物模型
① 中毒性肝纤维化动物模型。
② 异种动物血清诱导肝纤维化动物模型。
③ 乙醇诱导肝纤维化动物模型。
④ 二甲基亚硝氨诱导肝纤维化大鼠模型。
4. 肝移植动物模型
大鼠肝脏移植有原位肝脏移植和异位肝脏移植。大鼠原位肝脏移植所采用的方法有改良 Sun 法, 单套管法, 双套管法, 三套管法和吻合肝动脉的大鼠原位肝脏移植。小鼠肝脏移植主要是小鼠原位肝脏移植。
二、研究的主要脏器和细胞
肝脏是代谢研究中最重要的脏器。因此,代谢研究的主要对象包括肝脏、原代肝细胞、来源于肝脏的细胞系(HepG2、Huh7 等)等。除此之外,跟代谢密切相关的脏器或者组织还包括胰腺、肌肉、脂肪、小肠等;有时候巨噬细胞、内皮细胞等也属于代谢的研究范围……
三、病毒选择
目前主流的病毒载体三大金刚:慢病毒、腺病毒、AAV(腺相关病毒)。
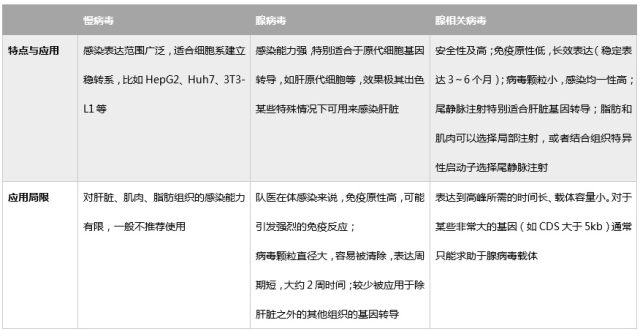
表 1 三种病毒的应用比较
如果是在体研究代谢,腺相关病毒(AAV)有着得天独厚的优势:AAV 颗粒直径小,滴度高,在胰腺、肠道、肌肉等组织中扩散均匀,极低的免疫原性,安全性好,可稳定表达 6 个月以上,AAV-8 感染胰腺效果较好,AAV-1/2/5 感染肠道效果较好,AAV-1/9 可用于对肌肉的感染,以上都体现了 AAV 在糖尿病研究中的优势,其作为最有前途的基因治疗利器,也是高分文章必备!而腺病毒在动物上表达效率低,有着高免疫原性,容易诱发免疫反应。慢病毒滴度低,效率低,在体水平表达较差。
四、注射方式
1. 肌肉注射(图 1):一般选取鼠前后肢部位注射,注射时针头要垂直快速刺入肌肉,如无回血现象即可注射。

图 1. 小鼠腓肠肌原位注射。左图是小动物活体成像,右图是冰冻切片荧光图
2. 尾静脉注射(图 2):即从动物尾部的静脉注射病毒,依靠血液循环到达目的组织器官,操作简方便,是目前使用最广的注射方式。

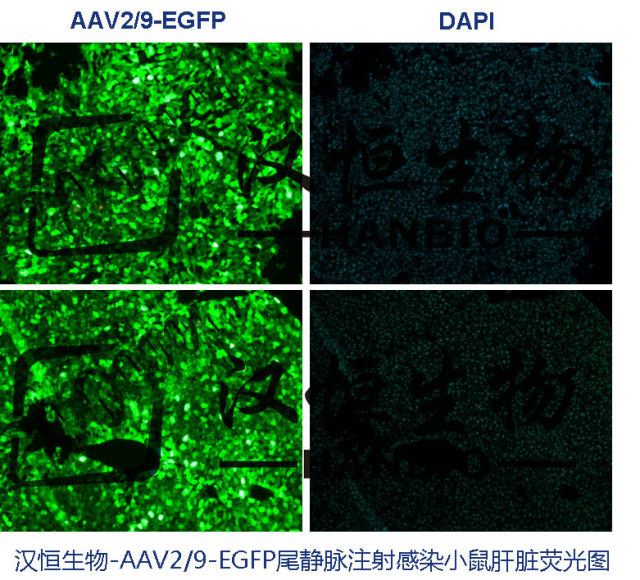
图 2. 小鼠尾静脉注射示意图和效果实例
3. 胰腺导管注射(图 3):可以实现对小鼠胰腺的局部感染,过程中需要对小鼠进行固定,手术,步骤繁多,操作起来略显麻烦。
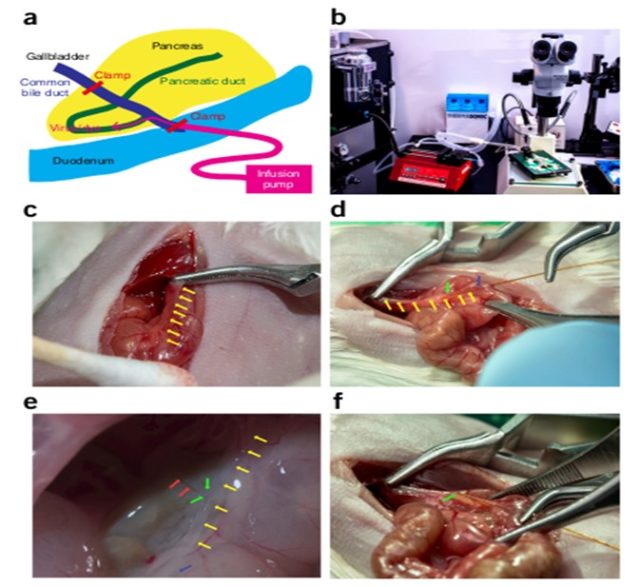
图 3. 胰腺导管注射图,采用 AAV-8,胰腺导管注射 150 μl
4. 肠系膜静脉注射:门静脉注射需要开腹寻找门静脉,腹腔会蒸发过多的水分,给实验动物造成额外的损伤,而肠系膜静脉注射手术切口小,静脉易寻找,手术时间短。
5、腹腔注射:对于胰腺的感染,某些 AAV 的特殊血清型非常适合腹腔注射。
6. 腹内脂肪-腹腔注射(图 4):用小鼠做实验时,以左手抓住动物,使腹部向上,右手将注射针头于左(或右)下腹部刺入皮下,使针头向前推 0.5~1.0 cm,再以 45 度角穿过腹肌,固定针头,缓缓注入药液,为避免伤及内脏,可使动物处于头低位,使内脏移向上腹。
图 4. 腹腔注射图,采用 AAV-9,大鼠腹腔注射 300 μl,小鼠腹腔注射 150~200 μl。
3. 皮下脂肪-原位注射(图 5):注射时,局部剪毛,可在注射局部用消毒棉球将被毛向四周分开,用 70% 酒精棉球消毒后,以左手的拇指、食指和中指将皮肤轻轻捏起,形成一个皱褶,右手将注射器针头刺入皱褶处皮下,深约 1.5~2 cm,药液注完后,用酒精棉球按住进针部皮肤,拔出针头,轻轻按压进针部皮肤即成。

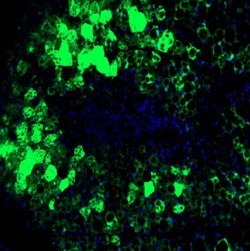
图 5. 皮下脂肪-原位注射和脂肪组织感染图,采用 AAV-9,大鼠和小鼠原位注射 10-15 μl /点,约 3-5 个点。
需要强调的是,对于肝脏 AV8 是公认的高效特异性靶向肝脏表达的病毒载体血清型。AAV9 比 AAV8 特异性稍差一些,但是感染效果较 AAV8 强(图 2)。AAV9 还可以在肌肉、中枢神经、肺等组织中表达。基于此,汉恒生物提供肝脏特异性 AAV,通过 AAV9,优选肝脏特异性启动子和其他分子元件,实现肝脏的高效基因转导:
①高感染表达率:汉恒强启动子载体 AAV9,通过静脉注射,高效感染肝脏,特异性上略差。
②高肝脏特异性 AAV:汉恒对一些肝脏启动子不同片段进行不同长短体的严筛,确定 TBG 特异性启动子,高特异地表达于肝脏(图 6)。肝脏中起始 TBG 正常转录的元件较多,因此在肝脏中相对表达量较其他部位高出很多。
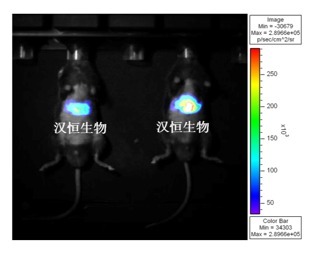
图 6. 肝脏特异性 AAV(AAV9-pTBG-Luc) 体内感染效果图,尾静脉注射 100 μl,感染 3 周,小动物活体成像。数据来源:汉恒实验室自验证。
当前无以此术语归类的内容。